最近更新于 2024-05-08 21:56
关系
键合
\begin{cases}
化学键(主价键)
\begin{cases}
离子键 \\
共价键 \\
金属键
\end{cases}
\\
氢键
\\
物理键(次价键):范德华力或称范德瓦尔斯力(van\ der\ Waals)
\end{cases}概念
离子键
原子失去或得到电子形成带电的离子,正负离子依靠静电吸引力结合在一起形成的键合。
无饱和性和方向性。高熔点,高硬度,高强度,低膨胀系数,塑性较差,固态不导电,熔融离子导电。
存在于金属与非金属形成的化合物中(大多数盐类、碱类和金属氧化物)。
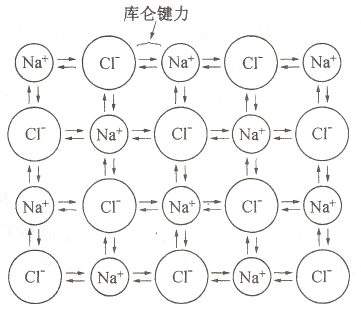 >
>
NaCl 离子键示意图
共价键
两个或多个电负性相差不大的原子间通过共用电子对形成的化学键。
有方向性和饱和性。高熔点高强度,高硬度,低热膨胀系数,塑性较差,不导电。
存在于非金属形成的化合物中。
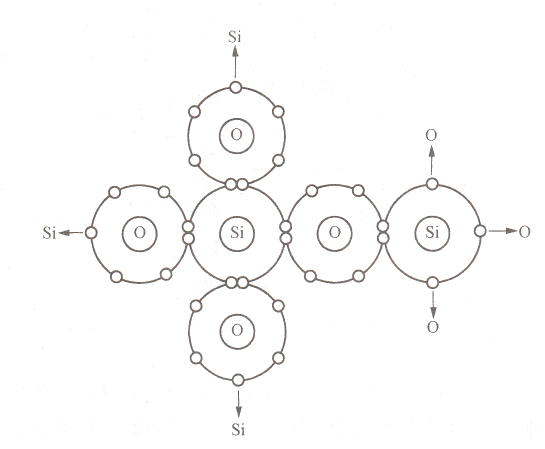
SiO_2中硅原子和氧原子间形成的共价键示意图
金属键
金属原子中价电子挣脱束缚成为自由电子,弥散于金属正离子组成的晶格中,由自由电子和金属正离子相互作用所构成的键合。
无饱和性和方向性。结构密堆,塑性较好,有光泽,良好的导热性和导电性。
存在于金属原子之间。
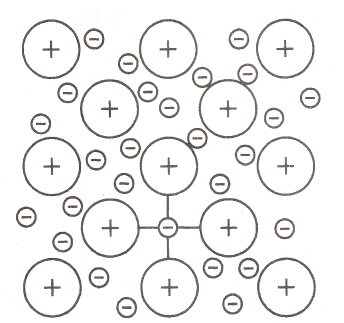
金属键示意图
范德瓦尔斯力
邻近原子相互作用引起电荷位移而形成偶极子,通过这种微弱、瞬时的电偶极矩的感应作用,将原子或分子结为一体的键合。
无饱和性和方向性;结构密堆,低熔点,绝缘。
存在于分子之间形成的晶体中,如Cl_2、Ar。
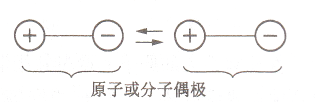
极性分子间范德瓦尔斯力示意图
氢键
分子中氢原子仅有的一个电子被分子中其它原子共有,氢端裸露出带正电荷的原子核,与邻近分子的负端相互吸引。
具有饱和性和方向性。高分子化合物氢键树木巨大,对其熔点及力学性能影响大;对小分子熔点、费电、溶解性、黏度也有一定影响。
存在于含有氢和氧、氮、氟等高电负性原子的分子之间,如H_2O、NH_3。
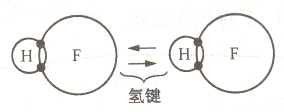
HF 氢键示意图
参考
- 胡庚祥, 蔡珣, 戎咏华. 材料科学基础. 第三版. 上海交通大学出版社. 2010.
键合
